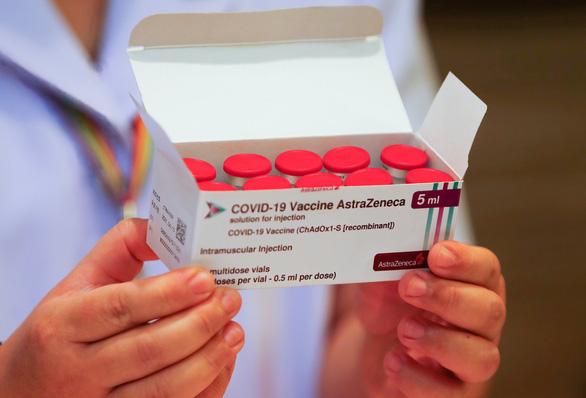
Nhân viên y tế Viện Bệnh nhiễm Bamrasnaradura ở tỉnh Nonthaburi (Thái Lan) cầm hộp vắc xin AstraZeneneca - Ảnh: GETTY IMAGES
Cơ quan Dược phẩm châu Âu (EMA) đã giao nhiệm vụ điều tra các nghi vấn về tác dụng phụ của vắc xin AstraZeneca cho Ủy ban Đánh giá nguy cơ cảnh giác dược (PRAC).
Ủy ban khoa học này được thành lập năm 2012 gồm một giám đốc, một phó giám đốc, một thành viên do mỗi quốc gia EU đề cử, sáu chuyên gia khoa học độc lập do Ủy ban châu Âu bổ nhiệm, hai đại diện chuyên gia y tế và hai đại diện các tổ chức bảo vệ bệnh nhân.
Thu thập dữ liệu từ khắp châu Âu
EMA đánh giá các nghi vấn về tác dụng phụ của vắc xin AstraZeneca thông qua phân tích chặt chẽ các dữ liệu.
Nguồn dữ liệu tra cứu xuất phát từ cơ sở dữ liệu EudraVigilance, nơi tập trung các báo cáo về phản ứng phụ do mạng lưới cảnh giác dược của các quốc gia thành viên EMA cung cấp.
GS dược học Bernard Bégaud tại Đại học Bordeaux (Pháp) giải thích với kênh truyền hình France Info cơ sở dữ liệu này không chỉ cung cấp số lượng ca bị tác dụng phụ mà còn thu thập nhiều đặc điểm lâm sàng quan trọng như hồ sơ bệnh nhân, biểu hiện của các triệu chứng, thời gian xảy ra triệu chứng.
PRAC còn tiếp xúc với các cơ quan liên quan ở các quốc gia EU để bảo đảm không bỏ sót các ca tiềm ẩn và cộng tác chặt chẽ với nhiều chuyên gia về rối loạn máu ở bên ngoài để giúp giải thích dữ liệu.
PRAC cũng tiếp xúc với Công ty dược phẩm AstraZeneca vì công ty này có lưu trữ dữ liệu riêng từ quá trình thử nghiệm lâm sàng.
Cuối cùng, EMA đã làm việc với cơ quan quản lý dược phẩm ở Anh để tham khảo kinh nghiệm quản lý khoảng 11 triệu liều vắc xin của Anh (Anh không còn là thành viên EMA).

Pháp nối lại chiến dịch tiêm chủng vắc xin AstraZeneca từ chiều 19-3 sau bốn ngày tạm ngưng - Ảnh: AFP
Trong bối cảnh bình thường, PRAC có thể đề nghị tiến hành nghiên cứu mới để xác định mối liên hệ có thể có giữa vắc xin AstraZeneca với chứng huyết khối. Lần này do tình hình cấp bách nên PRAC chỉ dựa vào các báo cáo cảnh giác dược.
Nhiều cách đánh giá rủi ro để đưa ra khuyến nghị
Ngoài số ca bị tác dụng phụ, PRAC chú trọng xem xét mức độ nghiêm trọng. Mức độ nghiêm trọng gồm nhiều cấp độ. Cao nhất là cấp độ "gây ảnh hưởng nghiêm trọng", tức gây tử vong, đe dọa tính mạng khẩn cấp, cần nhập viện hoặc có thể để lại di chứng.
Đầu tiên PRAC xem xét các tác dụng phụ có thuộc cấp độ nghiêm trọng hay không. Kế đến PRAC xem xét tính quy kết, tức mối tương quan giữa vắc xin AstraZeneca với tác dụng phụ.
Ví dụ chứng huyết khối xảy ra hai ngày, một tuần, một tháng sau khi tiêm vắc xin hay ngoài thời gian tiêm?
PRAC thảo luận vấn đề này với các chuyên gia về bệnh lý liên quan để có ý tưởng chính xác hơn về mối liên hệ nhân - quả. PRAC cũng phân tích tính tái lập, tức đánh giá xem các ca bị tác dụng phụ có những điểm giống nhau thế nào.

Trung tâm tiêm vắc xin AstraZeneca trong nhà thờ chính tòa Lichfield (miền trung nước Anh) ngày 18-3 - Ảnh: AFP
GS Bernard Bégaud nhận xét chứng huyết khối liên quan đến nhiều nguyên nhân và không có hồ sơ điển hình nào về chứng bệnh này. Dù vậy, nếu các ca tác dụng phụ có biểu hiện triệu chứng giống nhau và thuộc nhóm đối tượng cụ thể, khả năng liên quan đến vắc xin cao hơn.
Dựa vào đó, EMA sẽ đưa ra khuyến nghị cụ thể cho từng nhóm nguy cơ chứ không cần phải dừng toàn bộ công tác tiêm chủng.
PRAC còn so sánh tần suất huyết khối ghi nhận được nơi những người đã tiêm chủng với tần suất quan sát trong dân số nói chung. Từ đó EMA đã thông báo: "Tổng số biến chứng huyết khối tắc mạch nơi những người được tiêm chủng không cao hơn số quan sát thấy trong dân số nói chung".
Cuối cùng, PRAC không chỉ đánh giá liệu có rủi ro sau khi tiêm vắc xin hay không mà còn phải cân nhắc giữa rủi ro với lợi ích mong đợi.
Khuyến nghị không mang tính ràng buộc

Trung tâm tiêm chủng vắc xin ở Tournai (Bỉ) vẫn tiêm vắc xin AstraZeneca ngày 17-3 - Ảnh: EUROPE 1
Sau khi kết thúc quá trình điều tra, PRAC soạn văn bản trình bày các kết luận và khuyến nghị. Các thành viên ủy ban bỏ phiếu thông qua (chỉ cần đa số tuyệt đối).
Kết luận của PRAC không nhất thiết là kết luận chắc chắn về mức độ nguy hiểm của vắc xin AstraZeneca vì đây là vấn đề rất khó quyết định và còn là vấn đề ngoại giao.
Đáng lưu ý, PRAC không có thẩm quyền đưa ra quyết định mang tính chất ràng buộc, do đó kết luận chỉ là khuyến nghị về cách sử dụng hoặc không sử dụng vắc xin AstraZeneca.
Giả định PRAC đề nghị ngừng chiến dịch tiêm vắc xin, đề nghị sửa đổi hoặc thậm chí rút giấy phép lưu hành vắc xin, các quốc gia EU không còn lựa chọn nào khác ngoài thực hiện khuyến nghị.
Ngược lại, nếu PRAC khuyến nghị tiếp tục tiêm chủng, các quốc gia EU có quyền bỏ qua khuyến nghị hoặc tiến hành nghiên cứu riêng.

 3 năm trước
319
3 năm trước
319 








 English (United States) ·
English (United States) ·  Vietnamese (Vietnam) ·
Vietnamese (Vietnam) ·